此文对事件不作具体的评价,目的是梳理各方的进展和媒体的态度。
根据公开的报道,梳理疫苗事件如下:(2018年)7月5日,国家药监局会同吉林省局对长春长生公司进行飞行检查,在飞行检查中发现,长春长生生物科技有限责任公司的冻干人用狂犬病疫苗生产存在记录造假等严重违反《药品生产质量管理规范》的行为。
7月15日,国家药监局发布了《关于长春长生生物科技有限责任公司违法违规生产冻干人用狂犬病疫苗的通告》,同时,国家药监局会同吉林省局组成调查组进驻企业全面开展调查。

经查明,长生生物存在编造生产记录和产品检验记录,随意变更工艺参数和设备的现象。
国家药监局已责令企业停止生产,收回药品GMP证书,召回尚未使用的狂犬病疫苗。国家药监局会同吉林省局已对企业立案调查,涉嫌犯罪的移送公安机关追究刑事责任。
而这是长春长生生物科技继2017年10月被发现一批次百白破疫苗效价指标不符合标准规定之后,在不到一年的时间里再次出现严重违规行为。
根据《财经》的报道,7月20日,长生生物发布公告称,其全资子公司长春长生生物科技有限责任公司收到《吉林省食品药品监督管理局行政处罚决定书》,原因是该公司生产的“吸附无细胞百白破联合疫苗”(批号:201605014-01),经食品药品检定研究院检验,检验结果“效价测定”项不符合规定。
吉林省食药监局认为,长春长生行为违反《药品管理法》第49条第一款“禁止生产、销售劣药”的规定,并已经于2017年10月27日立案调查。

而深圳证券交易所也已经向长生生物公司连续两次下发关注函,要求长生生物公司说明长春长生公司生产疫苗情况。
7月20日,深交所启动对长生生物公司及相关当事人公开谴责的纪律处分程序。深交所表示,经对公司(长生生物)信息披露情况进行全面梳理、核查,初步发现其未及时披露被有关机关调查的信息、内部控制存在重大缺陷。
7月22日,国家药监局负责人通报长春长生违法违规生产冻干人用狂犬病疫苗案件有关情况。
7月22日晚间,长生生物回复深交所关注函称,目前公司百白破生产车间已经停产,公司正积极研究百白破组份疫苗以及以此为基础的多联疫苗。将进行彻底整改,确保生产的合规性、真实性、可靠性、可追溯性以及疫苗质量的安全性。其还表示,“经自查,未曾收到吉林食药监局出具的立案调查通知书”。

就在7月22日晚,因疫苗问题而备受关注的长生生物和康泰生物分别发布公告。长生生物表示,公司百白破生产车间已经停产。康泰生物则称,与其他疫苗企业没有股权关系和业务往来,公司与事件无关,经营有序,产品质量稳定,一切正常。
根据澎湃新闻的报道,在过去十多年中,不完全统计,长春长生及其母公司长春长生生物科技股份有限公司(002680,长生生物)至少涉入了12起受(行)贿案(注:受贿和行贿主体相同只计算一次),案情多为该公司销售人员或者地方经销商向当地负责疫苗采购的相关人员提供好处费、推广费、回扣款,以获得疫苗的优先采购或更大的采购份额。
而这12起案件集中发生在安徽、河南、福建、广东四省,时间跨度从2001年至2017年。
截至7月22日,上海、河南、海南、重庆、山东、山西、广西、河北这8个省市在内的疾控中心明确表示,全面停用、或是暂停使用长春长生狂犬病疫苗;湖南、福建、广东这3省疾控中心表示,该省境内没有涉事批次狂犬疫苗;西藏、北京、天津、江西四地疾控部门称,未采购长春长生公司狂犬病疫苗产品或是采购此次涉事疫苗批次。
昨日(7月22日)晚间,李克强针对闹得人心惶惶的疫苗事件再次作出批示:
此次疫苗事件突破人的道德底线,必须给全国人民一个明明白白的交代。
李克强在批示中要求,国务院要立刻派出调查组,对所有疫苗生产、销售等全流程全链条进行彻查,尽快查清事实真相,不论涉及到哪些企业、哪些人都坚决严惩不贷、绝不姑息。对一切危害人民生命安全的违法犯罪行为坚决重拳打击,对不法分子坚决依法严惩,对监管失职渎职行为坚决严厉问责。尽早还人民群众一个安全、放心、可信任的生活环境。
而此前在7月16日,李克强已经就疫苗事件作出过批示,要求彻查。
近日,各家媒体报社也都针对这件事作出评论和回应。
《人民日报》谈问题疫苗事件:
疫苗事关生命健康,质量安全容不得半点瑕疵,不能有一点侥幸。
构建“疫苗信任”,要“两只手”共同发力。一方面是,政府机构在疫苗生产、使用上的监管,需要更有力,对非法的生产经营行为“重拳治乱”,如果处罚只是“雨过地皮湿”,就形不成教训、也够不成震慑。同样重要的是,企业不能为了追求利益,把儿童的健康和家庭的幸福当做谋取非法利润的代价,“喻于利”的企业必须守住起码的道德底线,不能赚带着血的黑心钱。无论是生产企业还是监管部门,都必须以“敬畏生命”为信条,以更严格的生产标准、更严厉的常态监管、更严重的违法处罚规范行业发展,保住公众对疫苗的信任。
《人民日报》山东分社也谈疫苗事件:
如今的局势,则要求山东疾控等部门必须及时给出更有说服力的回应和更有力的行动。
新华社评论:
疫苗生产企业承担疫苗质量安全主体责任。针对企业故意造假的恶劣行为,要建立严格的惩戒体系,让企业为失信和违法违规行为付出沉重代价。涉事企业长生生物并非第一次出现问题。对疫苗这类全社会高度关注的行业,务必要建立行刑衔接制度,对违法违规企业“零容忍”,决不姑息纵容,建立带电的“高压线”。这就要求有关部门及时完善相关法律法规制度,加大处罚力度,例如建立一次违法终生禁入行业等制度,让违法者倾家荡产,真正让制度发挥强大的震慑作用。
今日(7月23日)早间,山东省疾控中心官网凌晨发布消息,称长生生物生产的流入山东的252600支不合格百白破疫苗的流向已查明。
这些疫苗,占全省年使用量的3.96%,流向济南、淄博、烟台、济宁、泰安、威海、日照、莱芜等8个市。这批疫苗已接种247359支,损耗、封存5241支,涉及儿童215184人,目前,涉及儿童未发现疑似预防接种异常反应增高,将开展后续补种工作。通告还显示,受到国家药品监督管理局通报的长春长生公司违规违法生产的狂犬病疫苗未流入山东省。
同样在今日(7月23日)早间,深圳证券交易所公告称,长生生物科技股份有限公司拟披露重大事项,根据本所《股票上市规则》和《中小企业板上市公司规范运作指引》的有关规定,经公司申请,公司股票(证券简称:长生生物,证券代码:002680)于2018年7月23日开市起临时停牌,待公司通过指定媒体披露相关公告后复牌。

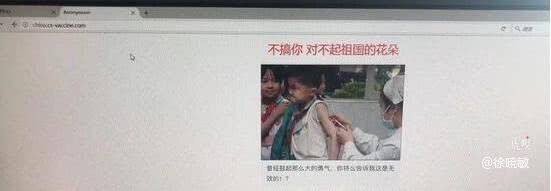
并且有最新消息称,长生科技官网首页被黑客攻击并配图“不搞你,对不起祖国的花朵”。随后,打开长生生物官网显示网站已无法打开,错误提示404。